DECODIFICACIÓN DEL GENOMA
Genética y biología celular del cáncer: neoplasias linfoblásticas T
Descripción
Las neoplasias linfoblásticas T son enfermedades hematológicas que necesitan de manera urgente la identificación de nuevos biomarcadores que permitan su estratificación y el ajuste de las dosis de los fármacos utilizados. Por tanto, el objetico central de nuestro trabajo es la identificación de nuevos biomarcadores moleculares para proponer tratamientos más efectivos y menos tóxicos. A tal efecto nuestro planteamiento ha sido abordar el análisis de modelos animales y de muestras de tumores primarios mediante aproximaciones genómicas y transcriptómicas como punto de partida para la identificación de nuevos “drivers” y mecanismos implicados. En los últimos años hemos demostrado la implicación de la sobre-expresión de oncogenes críticos (tales como c-MYC, ABL1, BCR-ABL y SMO) debido al efecto combinatorio de la inactivación de múltiples microRNAs, y la inactivación de genes supresores mediante el efecto simultáneo de deleciones y alteraciones epigenéticas (CDKN2A, CDKN2B and EPHA7). Nuestros datos evidenciaron un considerable grado de heterogeneidad intratumoral alimentada por procesos de editado de RNA. Entre nuestras contribuciones más recientes hemos demostrado que la desregulación del eje CDKN1C-E2F1-TP53 mediante mecanismos epigenéticos y la desregulación de microRNAs puede ser un predictor de agresividad tumoral. Aprovechando los datos derivados de la secuenciación de exomas y la versatilidad del RNA-seq hemos identificado nuevas mutaciones y cambios de expresión génica que sirven para la propuesta de nuevas terapias dirigidas en el contexto de una medicina personalizada de precisión. Nuestros resultados también han servido para identificar nuevos transcritos de fusión que podrían comportarse como nuevos “drivers” o contribuyentes en el proceso tumoral. También hemos demostrado que la inactivación de diferentes isoformas del gen supresor FBXW7 es una condición sine qua non para inducir un patrón proliferativo en las células tumorales. Además hemos demostrado que la fosforilación de FADD puede servir como predictor de estatus clínico y agresividad. Finalmente hemos demostrado que la inhibición de la actividad aconitasa con fluorocitrato disminuye la viabilidad de las células tumorales que presentan un déficit parcial de actividad ACO1. Este hallazgo fue confirmado mediante experimentos in vivo con xenotrasplantes inducidos en ratón mediante la inoculación de células tumorales derivadas de neoplasias linfoblásticas T. Nuestro interés más reciente se centra en evaluar la implicación de los procesos de editado de RNA, el tráfico de exosomas y la desregulación de genes no codificantes (largos y cortos) para conseguir una visión integral completa de las complicadas redes de mecanismos de regulación alterados en este tipo de neoplasias hematológicas. Nuestra pertenencia al CIBER de enfermedades raras y al Instituto de Investigación Sanitario Fundación Jiménez Díaz está facilitando nuestra capacidad traslacional.
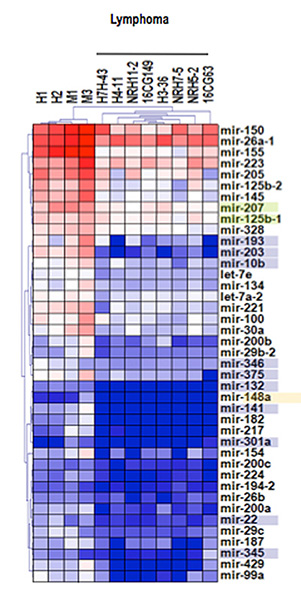
Figura 2. Perfiles transcripcionales de miRNAs en linfomas linfoblásticos T murinos.
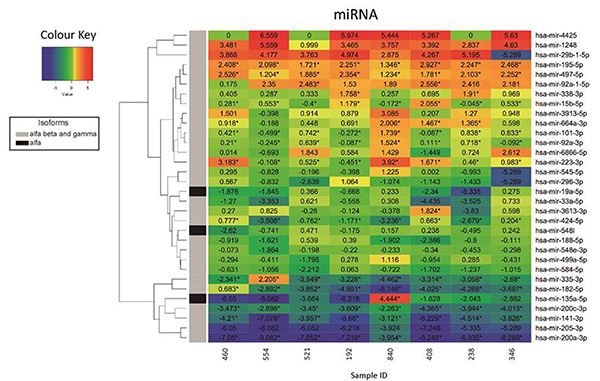
Figura 3. Representación gráfica (Heatmap) de los cambios en la expression de microRNAs especificos mediante RNA-seq.
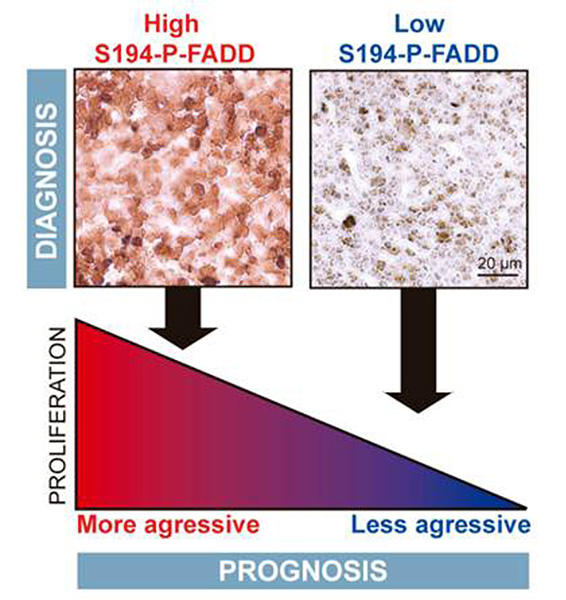
Figura 4. Modelo de asociación entre la fosforilación de FADD y el pronóstico de linfomas linfoblásticos T.
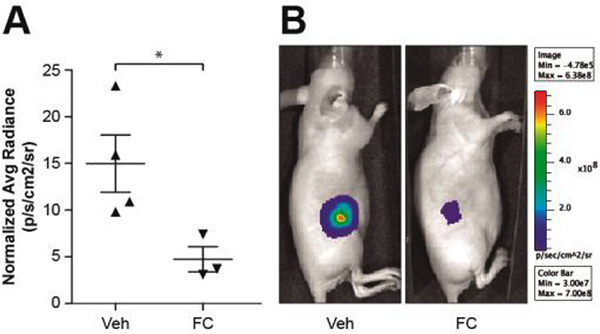
Figura 5. Efecto del fluorocitrato sobre tumores inducidos en ratones mediante xenotransplante de células tumorales derivadas de una neoplasia linfoblástica T.
Personal
Ejemplo: Jaime Millán Martínez
Alfonso Blázquez Castro
Mª Angeles Cobos Fernández
José Fernández Piqueras
Iria González Vasconcellos
